2018 aastal laekunud ravimite (sh vaktsiinide) võimalike kõrvaltoimete teatised
19.02.2019- aastal laekunud ravimite (sh vaktsiinide) võimalike kõrvaltoimete teatised
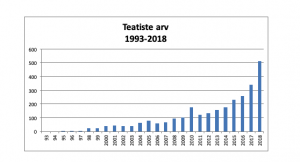
Ravimiametile laekus 2018. aastal 512 kõrvaltoime teatist (neist 3 olid duplikaadid), milles kirjeldati 1275 võimalikku kõrvaltoimet.
KES 2018 A. TEATISI SAATSID?
Tervishoiutöötajad saatsid 303 teatist:
- 125 teatist Ravimiametile
- 178 teatist müügiloa hoidjale (neist 34 teatist organiseeritud ohutusandmete kogumise raames müügiloa saamise järgsetest uuringutest või programmidest)
Patsiendid saatsid 184 teatist:
- 93 teatist Ravimiametile (ühel korral apteekri abiga)
- 91 teatist müügiloa hoidjale (kuuel korral apteekri abiga)
Müügiloa hoidjad edastasid Ravimiametile 20 teatist meditsiinikirjanduses avaldatud juhtudest, kus kirjeldati kõrvaltoimeid, mis tekkisid ravimite kasutamisel Eestis ning neli teatist ajakirjanduse avaldatud juhtudest. Ühe meditsiinikirjanduses avaldatud juhu edastas Euroopa Ravimiamet.
Kolm teatist olid duplikaadid (esmase teatise saatis patsient või arst ja samast kõrvaltoimest teavitas ka müügiloa hoidja).
KÕRVALTOIMETE TÕSIDUS JA SEOS RAVIMI/VAKTSIINIGA
| Kõrvaltoime (KT) teatiste jaotumine tõsiduse järgi | ||||
| Teatiste arv kokku | Tõsist KT sisaldavate teatiste arv | Teatises kirjeldatud võimalike KT arv* | Nendest tõsiseid KT | |
| Kokku | 509** | 177 (34,8%) | 1275 | 385 |
| Ravimid , v.a vaktsiinid | 396 | 154 (38,9%) | 937 | 344 |
| Vaktsiinid | 113 | 23 (20,4%) | 338 | 41 |
*Ühes teatises kirjeldatakse sageli mitut kõrvaltoimet.
** 512 teatisest kolm olid duplikaadid ning kirjeldasid samu kõrvaltoimeid.
Tõsisteks kõrvaltoimeteks liigitakse järgmised reaktsioonid:
- ravimitest põhjustatud surmajuhtumid,
- eluohtlikud reaktsioonid ravimite manustamisel (termin „eluohtlik“ tähendab antud juhul seda, et reaktsiooni ajal oli patsiendi seisund eluohtlik, mitte et reaktsioon võiks hüpoteetiliselt olla eluohtlik, kui ta oleks tõsisem),
- püsivaid tervisehäireid tekitanud reaktsioonid ja kõrvaltoimed (sh invaliidsus),
- töövõimetust põhjustanud ravimite kõrvaltoimed,
- haiglaravi vajanud või seda pikendanud reaktsioonid ravimitele,
- ravimitest põhjustatud väärarengud,
Samuti on olulised järgmised:
- haiguse kestust ja kulgu mõjutanud kõrvaltoimed,
- ravimite koostoimetest tingitud tõsised reaktsioonid,
- ravimsõltuvuse teke,
- muud tõsised või meditsiiniliselt olulised reaktsioonid ravimitele.
Ravimite (sh vaktsiinide) kõrvaltoime teatiste jaotus soo ja vanuse järgi
| Sugu | Teatiste arv | Vanusegrupp | Teatiste arv |
|
Naine |
301 | 0 – 1 kuu | 0 |
| 2 kuud – 2 aastat | 26 | ||
| 3 aastat – 11 aastat | 15 | ||
| 12 aastat – 17 aastat | 20 | ||
| 18 aastat – 64 aastat | 147 | ||
| 65 aastat – 85 aastat | 67 | ||
| 86 aastat ja vanemad | 4 | ||
| teadmata | 22 | ||
|
Mees |
193 | 0 – 1 kuu | 1 |
| 2 kuud – 2 aastat | 36 | ||
| 3 aastat – 11 aastat | 10 | ||
| 12 aastat – 17 aastat | 1 | ||
| 18 aastat – 64 aastat | 86 | ||
| 65 aastat – 85 aastat | 37 | ||
| 86 aastat ja vanemad | 1 | ||
| teadmata | 21 | ||
|
Teadmata |
15 | 0 – 1 kuu | 0 |
| 2 kuud – 2 aastat | 1 | ||
| 3 aastat – 11 aastat | 0 | ||
| 12 aastat – 17 aastat | 0 | ||
| 18 aastat – 64 aastat | 4 | ||
| 65 aastat – 85 aastat | 3 | ||
| 86 aastat ja vanemad | 0 | ||
| teadmata | 7 | ||
Ravimite tõsised kõrvaltoimed
Tähelepanu! Järgnevalt toodud võimalike kõrvaltoimete ja ravimite vahelise seose interpreteerimisel peab olema ettevaatlik, sest mainitud kõrvaltoimed ei pruugi olla ravimist tingitud ning nende andmete põhjal ei tohi erinevaid ravimeid omavahel võrrelda.
Kõrvaltoime teatises esitatud andmed ei pruugi olla piisavad reaktsiooni hindamiseks ja lõplike järelduste tegemiseks.
Ravimi kõrvaltoimetest teatamine sõltub paljudest teguritest, nt sellest, kui laialdaselt ravimit kasutatakse, kui pikaajaliselt on ravim juba kasutusel olnud, samuti meedia huvist ravimi vastu ning arstide ja patsientide suhtumisest teatiste saatmisse. Seetõttu kajastavad esitatud andmed ainult osa ravimi kasutamisel ilmnevatest kõrvaltoimetest ja ainult selles kokkuvõttes esitatud andmete alusel ei saa tuletada tegelikku kõrvaltoimete esinemissagedust. Esitatud üksikjuhtude põhjal ei saa ravimeid omavahel võrrelda ega põhjapanevaid järeldusi teha.
Tõsised kõrvaltoimed ravimrühmade kaupa
Alljärgnev kokkuvõte on ravimite ja vaktsiinide kõrvaltoime teatiste kohta, mille puhul ravimi ja kõrvaltoime vaheline seos on hinnatud vähemalt võimalikuks.
Kui kahtlustatavaid ravimeid on rohkem kui üks, siis on tabelisse kantud peamise kahtlustatava ravimi ATC-kood.
| ATC kood | Ravimrühm | Tõsist KT sisaldanud teatiste arv | Seni-teadmata KT sisaldanud teatiste arv | Surmaga lõppenud KT sisaldanud teatiste arv |
| B01A | Tromboosivastased ained | 39 | 2 | |
| L04 | Immunosupressandid | 29 | 3 | |
| J07 | Vaktsiinid | 23 | 3 | 1 |
| L01 | Kasvajavastased ained | 19 | 1 | 7 |
| G02BA | Emakasisesed hormonaalsed kontratseptiivid, levonorgestreel | 8 | ||
| J01 | Antibakteriaalsed ravimid | 7 | ||
| C09D | Reniin-angiotensiinsüsteemi toimivad ained | 5 | 1 | |
| C01A | Südameglükosiidid | 3 | ||
| D10BA | Aknevastased preparaadid | 3 | ||
| G04BE | Erektsioonihäirete ravimid | 3 | 2 | |
| J05A | Viirusvastased ravimid | 3 | 1 | |
| R03DX | Hingamisteede obstruktiivsete haiguste raviks kasutatavad ained | 3 | ||
| V08 | Kontrastained | 3 | ||
| A10B | Vere glükoosisisaldust vähendavad ained (sh kombinatsioonid), v.a insuliinid | 2 | ||
| B03 | Aneemiavastased preparaadid | 2 | 1 | |
| C08CA | Kaltsiumikanali blokaatorid | 2 | ||
| H03BB | Kilpnäärme ravimid | 2 | ||
| L03 | Immunostimulaatorid | 2 | ||
| M01A | Põletiku- ja reumavastased ravimid | 2 | ||
| N06A | Antidepressandid | 2 | ||
| S01 | Silmahaiguste ravimid | 2 | ||
| A07EC | Soolepõletikuvastased ravimid | 1 | ||
| A08A | Rasvumisvastased ained | 1 | ||
| C01B | Antiarütmikumid, I ja III klass | 1 | ||
| G02CB | Teised günekoloogilised ravimid (dopaminergilised) | 1 | 1 | |
| G03AA | Suukaudsed hormonaalsed kontratseptiivid | 1 | ||
| G03AB | Kontratseptiiv (implantaat) | 1 | ||
| G04CA | Uroloogias kasutatavad ained | 1 | 1 | |
| M04A | Podagravastased ravimid | 1 | ||
| N05 | Psühholeptikumid | 1 | 1 | |
| N07B+J05 | Sõltuvuse vastased ravimid ja viirusevastased ravimid | 1 | 1 | |
| P03AX | Parasiitide vastased ravimid | 1 | ||
| R01AD | Nasaalsed preparaadid, kortikosteroidid | 1 | ||
| R03AK | Inhaleeritavad adrenergilised ravimid | 1 | ||
| 177 | 8 | 18 |
Surmaga lõppenud reaktsioonid 2018. aastal
Surmaga lõppenud reaktsioonidest teatati 18 korral.
11 korral teatati surmaga lõppenud reaktsioonidest, mille puhul seost ravimi ja surmani viinud reaktsioonide vahel hinnati tõenäoliseks või võimalikuks.
- Neljas teatises kirjeldati kasvajavastaste ravimite (pembrolizumab, bortesomiib, bortesomiib kombinatsioonis tsüklofosfamiidi ja deksametasooni või talidomiidi ja deksametasooniga) kasutamisel surma põhjustanud reaktsioone: infektsioon, septiline šokk, kateeterinfektsioon, hingamispuudulikkus. Üks patsient oli üle 60- ning kolm patsienti üle 70-aasta vanuses, kelle põhihaiguseks oli IV staadiumi kopsuvähk (1) või müeloomtõbi (3). Infektsioonid on kasvajavastaste ainete ja immunosupressantide teadaolev risk.
- Kahes teatises kirjeldati reumatoidartriidi ravimite (golimumab, metüülprednisoloon, leflunomiid, metotreksaat) kasutamisel surma põhjustanud reaktsioone. Ühes teatises kirjeldati 67-aastasel patsiendil divertiikuli perforatsiooni ja abstsessi ning sepsist. Golimumab võib põhjustada seedetrakti põletikulist haigust ja abstsesse, metüülprednisoloon sooleperforatsiooni ja leflunomiid samuti tõsiseid infektsioone (sh fataalset sepsist). Teises teatises kirjeldati 73-aastasel patsiendil raviveast tingitud metotreksaadi mürgistust, mis põhjustas pantsütopeenia, neutropeenilise sepsise, septilise šoki, seedetrakti verejooksu. Reumatoidartriidi korral tuleb metotreksaati võtta 1 kord nädalas, kuid patsient võttis seda kord päevas. Arst peab metotreksaati võtvale reumatoidartriidiga patsiendile selgitama õiget annustamist ja veenduma, et patsient saab juhistest aru.
- Kahes ajakirjandusest pärineva teabe põhjal saadetud teatises kirjeldati erektsioonihäire ravimi sildenafiili ning narkootiliste ainete ja alkoholi tarvitamisel surma põhjustanud mürgistust ja südameseiskust.
- Ühes teatises kirjeldati 70-ndates aastates patsiendil tromboosivastase ravimi rivaroksabaani kasutamisel surma põhjustanud maoverejooksu. Verejooks on rivaroksabaani ja teiste tromboosivastaste ravimite teadaolev risk.
- Ühes meditsiinikirjanduses ilmunud artikli põhjal saadetud teatises kirjeldati eakal alkoholi tarvitanud patsiendil segasusseisundi tõttu diasepaami ja haloperidooli kasutamise järgselt tekkinud südame äkksurma.
- Tuberkuloosivaktsiini kasutamisega seotud surmajuhtumi kohta vt allpool „Vaktsiinide kõrvaltoimed“.
7 korral ei olnud võimalik seost ravimiga hinnata või oli seos ebatõenäoline
- Kahes teatises kirjeldati 73- ja 57-aastasel patsiendil kopsuvähi raviks kasvajavastase ravimi pembrolizumabi kasutamisel surmani viinud reaktsioonina seedetrakti ja kopsu verejooksu (1) ja seedetrakti infektsiooni (2). Patsiendid olid raskes üldseisundis ja kaasuvate haigustega.
- Ühes meditsiinikirjanduses ilmunud artikli põhjal saadetud teatises kirjeldati 19-aastasel naisel rinnavähi korral mitme kasvajavastase ravimi kasutamisel surmani viinud reaktsioone. Patsiendil oli väga agressiivne ja multiresistentne vähivorm, surm oli tõenäoliselt tingitud haiguse süvenemisest.
- Ühes teatises kirjeldati kopsutransplantaadi raviks takroliimust saanud 49-aastasel patsiendil surma põhjusena posterioorset reversiibelset entsefalopaatia sündroomi, koomat, aju verejooksu, ajukahjustust, ajuturset. Kaasuvate ravimite kohta teave puudub, andmed olid põhjusliku seose hindamiseks puudulikud.
- Kahes teatises kirjeldati tõsiste kaasuvate südamehaigustega patsientidel valsartaani ja sakubitriili ning metoprolooli ja apiksabaani kasutamisel surma põhjustanud koronaarpuudulikkust ja äkksurma.
- Ühes teatises kirjeldati 37-aastasel patsiendil metadooni ja C-hepatiidi ravimi glekapreviiri ja pibrentasviiri kasutamisel suitsiidi. Samas puuduvad lahangu andmed ning ei ole teada, mis ravimeid suitsiidil kasutati.
RAVIMITEABES SENI KIRJELDAMATA RAVIMITE TÕSISED KÕRVALTOIMED
8 teatises kirjeldati kõrvaltoimeid (17), mida seni ei ole selle ravimi või vaktsiiniga seostatud.
Seniteadmata kõrvaltoimeteks liigitatakse sellised ravimi kasutamisel ilmnevad reaktsioonid, mida ei ole varem piisava sagedusega ilmnenud ning nende seos ravimiga ei ole kindel, mistõttu ei ole neid ka ravimiteabes (ravimi omaduste kokkuvõte/pakendi infoleht) kirjeldatud. Turuletuleku järgselt on tähelepanu keskmes selliste kõrvaltoimete avastamine. Kui mõnest reaktsioonist teatatakse sagedamini ja hinnangu tulemusel selgub, et reaktsiooni ja ravimi vahel on seos, siis see kõrvaltoime lisatakse ravimiteabesse.
Alljärgnevalt on toodud juhtude loetelu, mille puhul ravimi ja reaktsiooni tekke vahel esines vähemalt ajaline seos ja muud põhjused ei luba välistada seost ravimi ja reaktsiooni vahel. Mainitud reaktsioonid ei pruugi olla ravimist tingitud ning nende andmete põhjal ei tohi ega saa erinevaid ravimeid omavahel võrrelda või anda hinnanguid nimetatud ravimitele.
| Ravim (grupp) | Kõrvaltoime | Kõrvaltoime kulg |
| Alfadarbepoetiin (aneemiavastane ravim) | Hemolüüs, neerukahjustus | Teadmata |
| Tamsulosiin, alfusosiin (uroloogias kasutatavad ravimid) | Katarakt (kae) | Ravi muudeti, tehti katarakti operatsioon, patsient paranes |
| Bromokriptiin (günekoloogias kasutatav ravim) | Miktsioonisünkoop (minestamine, krambid) | Ravi lõpetati, patsient paranes |
| Dasabuviir, ombitasviir+ paritapreviir+ ritonaviir (viirusevastased ained) | Hüpereemia, halb enesetunne, veritsus, hüpereemia, turse | Ravi lõpetati, patsient paranes |
| Pembrolizumab (kasvajavastane ravim) | Üldseisundi halvenemine, hingamispuudulikkuse süvenemine, segasus | Surm (vt „Surmaga lõppenud reaktsioonid 2018. aastal“) |
Rotaviiruse vaktsiini, inimese papilloomiviiruse vaktsiini ja viievalentse vaktsiini kasutamisel kirjeldatud seni ravimiteabes kirjeldamata kõrvaltoimete kohta loe rubriigist: „Vaktsiinide kõrvaltoimed“.
VAKTSIINIDE KÕRVALTOIMED
- aastal saadeti Ravimiametile 114 teatist* vaktsiinide võimalike kõrvaltoimete kohta, neist 23 teatises kirjeldati vähemalt ühte tõsist kõrvaltoimet.
*Üks teatis oli duplikaat – samast kõrvaltoimest teatasid nii arst kui müügiloa hoidja.
Vaktsiinide kõrvaltoime teatiste jaotus soo ja vanuse järgi
| Sugu | Teatiste arv | Vanusegrupp | Teatiste arv |
|
Naine |
66 | 2 kuud – 2 aastat | 22 |
| 3 aastat – 11 aastat | 11 | ||
| 12 aastat – 17 aastat | 17 | ||
| 18 aastat – 64 aastat | 13 | ||
| 65 aastat – 85 aastat | 2 | ||
| teadmata | 1 | ||
| Mees
|
46 | 2 kuud – 2 aastat | 34 |
| 3 aastat – 11 aastat | 7 | ||
| 18 aastat – 64 aastat | 4 | ||
| 65 aastat – 85 aastat | 1 | ||
| Teadmata | 1 | 2 kuud – 2 aastat | 1 |
Järgnevas kokkuvõttes põhinevad riikliku immuniseerimiskava vaktsiinide kasutusandmed Terviseametile esitatud aruannetel (mitu isikut 2018 a. vaktsineeriti) ja immuniseerimiskava väliste vaktsiinide puhul Eesti hulgimüügi statistika andmetel (mitu vaktsiiniannust apteekidele/haiglatele/arstidele väljastati).
Vaktsiinide kasutamisel teatatud TÕSISED kõrvaltoimed – 23 teatist
Rotaviiruse nõrgestatud vaktsiin (16 teatist)
- 12 juhul haigestusid lapsed rotaviiruslikku gastroenteriiti, kuigi olid saanud kõik immuniseerimiseks vajalikud annused (sõltuvalt vaktsiinist 2 või 3 annust).
- Kahel juhul haigestusid lapsed rotaviiruslikku gastroenteriiti enne täieliku vaktsinatsioonikuuri läbimist või vahetult pärast viimast annust.
- Ühel juhul tekkis haiglaravi vajanud kõhulahtisus ja palavik 2 päeva pärast rotaviiruse vaktsiini 1. annust. Lisaks sai laps samal päeval B-hepatiidivastast ja viievalentset vaktsiini.
- Ühel juhul tekkisid lapsel rotaviiruse vaktsiini 1. annuse järgselt seedehäired, gaasivalud ja atoopiline dermatiit ning 2. annuse järgselt tekkisid uuesti gaasivalud ning atoopiline dermatiit ägenes. Samaaegselt rotaviiruse vaktsiiniga sai laps kuuevalentset vaktsiini.
14 teatise puhul on seos rotaviiruse vaktsiini ja reaktsiooni vahel tõenäoline või võimalik. Kahel juhul ei ole võimalik seost hinnata. Kahtlustati toime puudumist, kuid lapsed ei olnud läbinud täielikku vaktsineerimisskeemi, mistõttu ei saanud hinnata, kas lapsel tekkinud gastroenteriidi sümptomid võisid olla tingitud täielikult väljakujunemata immuunsusest või teise infektsiooni ja vaktsinatsioonijärgse vaktsiiniviiruse erituse tõttu). Kõik 16 last paranesid täielikult.
Ükski vaktsiin ei ole 100% efektiivne. Efektiivsus sõltub ühelt poolt haigustekitajast (viirusel on mitmeid erinevaid genotüüpe ja kõigi vastu ei pruugi vaktsiin ühesuguselt efektiivne olla), teiselt poolt on organismil erinev võime kaitsekehi toota. Efektiivsus kujuneb välja esmase vaktsinatsioonikuuri käigus ning sõltub, kui täpselt on optimaalset vaktsinatsioonikuuri järgitud. Aja jooksul hakkab immuunsus vähenema. Vaktsiin hoiab ära enamuse raskeid ning potentsiaalselt surmavaid haigusi. Vaktsiini kõrvaltoimed ei ole ohtlikumad kui haigus ise. Raskeid kõrvaltoimeid esineb väga harva. Ravimiametile teatatud juhtude puhul vajasid lapsed haiglaravi vaid mõne päeva vältel ning paranesid kiiresti.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a rotaviiruse vaktsiiniga 10 802 last.
Tuberkuloosi nõrgestatud elusvaktsiin (BCG) (3 teatist)
- Sünnitusmajas vaktsiini saanud lapsel tekkis 2 kuu vanuselt lümfisõlmede abstsess. See on teadaolev harvaesinev kõrvaltoime. Sageli seostatakse abstsesside teket vale vaktsineerimise tehnikaga (liiga sügavale tehtud süst suurendab abstsessi tekkeriski). Laps paranes.
- Sünnitusmajas vaktsiini saanud ja umbes 4 kuu vanuselt granulomatoostõppe (geneetiline immuunsüsteemi kahjustav haigus) haigestunud lapsel tekkis dissemineerunud BCG infektsioon. Granulomatoostõve tõttu tehti luuüdi siirdamine, kuid sellele järgnes luuüdi hülgamise reaktsioon ning immuunsuse languse tõttu lisandus ka muu bakteriaalne infektsioon. Laps saab jätkuvalt tuberkuloosivastast ravi, planeeritud on uus luuüdi siirdamine.
- Sünnitusmajas vaktsiini saanud ning 4 kuu vanuses leukeemiasse (verevähk) haigestunud lapsel tekkis immuunsuse languse tõttu BCG üldinfektsioon, mis ei allunud tuberkuloosivastasele ravile. Laps suri BCG üldinfektsiooni 9 kuu vanuselt.
Tuberkuloosi nõrgestatud elusvaktsiin on vastunäidustatud, kui vastsündinul on immuunpuudulikkus. Kahel BCG üldinfektsiooni juhul olid lapsed sündides terved. Immuunsuse langus muu põhihaiguse (kasvajaline verehaigus ja immuunsüsteemi kahjustav haigus) tõttu võimaldas süstekohas olevatel antigeenidel, st tuberkuloosi nõrgestatud elus bakteritüvedel põhjustada süsteemset infektsiooni.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a tuberkuloosi vaktsiiniga 13 306 last.
Difteeria, teetanuse, läkaköha, poliomüeliidi neljavalentne vaktsiin (1 teatis)
- 7-aastasel lapsel tekkis anafülaktiline reaktsioon. Laps vajas kohest ravi ning paranes täielikult.
Anafülaktilised ja allergilised reaktsioonid tekivad tavaliselt 5-30 minutit pärast vaktsineerimist. Seetõttu soovitatakse jääda tervishoiuasutusse jälgimisele vähemalt 10 minutiks pärast süsti. Arstiga tuleks koheselt ühendust võtta, kui pärast tervishoiuasutusest lahkumist tekib lapsel mõni neist sümptomitest: järsk ja tõsine enesetunde halvenemine, pearinglus ja teadvusekadu (vererõhu langusest), kiirenenud südamerütm koos hingamishäiretega, samuti järsku tekkiv näoturse.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a neljavalentse vaktsiiniga 13 959 last.
Difteeria, teetanuse, läkaköha, poliomüeliidi, Haemophilus influenza B tüüp viievalentne vaktsiin (1 teatis).
- 6-kuusel lapsel tekkisid 4 päeva pärast vaktsineerimist öine äkiline hingamisraskus, paanikahoog ja larüngiit. Laps vajas haiglaravi ning paranes täielikult. Kuigi ajaliselt tekkisid reaktsioonid vaktsineerimise järgselt, olid need pigem tingitud samaaegsest viirusinfektsioonist.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a viievalentse vaktsiiniga 25 593 last.
Puukentsefaliidi inaktiveeritud vaktsiin (1 teatis)
- 8-aastane laps haigestus puukentsefaliiti vaatamata esmasele vaktsinatsiooniskeemile kolme annusega ning ühele tõhustusannusele. Laps oli haiglaravil ning paranes.
- aastal väljastati Eestis hulgimüügist ligikaudu 90 677 puukentsefaliidi vaktsiini annust (sh 27 069 laste vaktsiini).
Papilloomiviiruse vaktsiin (1 teatis)
- 12-aastasel tüdrukul tekkis nädal pärast vaktsineerimist süstekoha reaktsioon, vaktsinatsioonikoha tihkenemine, hiljem kujunes vaktsinatsioonikoha abstsess, mis vajas antibakteriaalset ravi.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a papilloomiviiruse vaktsiini ühe annusega 4743, kahe annusega 9021 ja kolme annusega 105 tütarlast.
Vaktsiinide kasutamisel teatatud MITTETÕSISED kõrvaltoimed – 91 teatist
Rotaviiruse nõrgestatud vaktsiin (13 teatist)
- Enamuses teatistes kirjeldati teadaolevaid kõrvaltoimeid: nahalööve, unehäired, rahutus, loidus, nutuhood, kõhupuhitus, kõhulahtisus, kõhukinnisus, toidu tagasiheide/oksetlemine, isutus, palavik.
- Kolmes teatises kirjeldati kõrvaltoimeid, mida tänastele teadmistele tuginedes ei ole rotaviiruse vaktsiiniga seni seostatud: unisus (ka antud juhul võib see olla tingitud seedehäiretega seotud vedelikupuudusest) ja võimetus iseseisvalt roojata ning atoopiline dermatiit.
Lapsed said samaaegselt nelja-, viie-, või kuuevalentset vaktsiini.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a rotaviiruse vaktsiiniga 10 802 last.
Difteeria, teetanuse vaktsiin lastele (1 teatis)
- 7-kuusel lapsel tekkis jäsemetel lööve. Laps paranes täielikult (raviks niisutav kreem).
- aastal väljastati Eestis hulgimüügist lastele mõeldud difteeria-teetanuse vaktsiini umbes 370 annust.
Difteeria, teetanuse vaktsiin täiskasvanutele (2 teatist)
- täiskasvanutel kirjeldati teadaolevaid reaktsioone: palavik, iiveldus, peavalu, nõrkus, süstekoha sügelus, punetus, turse ja tihkenemine. Üks isik sai samaaegselt puukentsefaliidi vaktsiini. Reaktsioonidest paraneti täielikult.
Terviseametile esitatud aruannete kohaselt väljastati 2018. a 28 838 difteeria-teetanuse vaktsiini annust.
Difteeria, teetanuse, läkaköha, kolmikvaktsiin (1 teatis)
- 15-aastasel noorukil tekkisid süstekoha valu, turse ja punetus, mis möödusid paikse raviga.
- aastal väljastati Eestis hulgimüügist 11 675 difteeria-teetanuse-läkaköha vaktsiini annust.
Difteeria, teetanuse, läkaköha, poliomüeliidi neljavalentne vaktsiin (14 teatist)
- Enamuses teatistes kirjeldati teadaolevaid kõrvaltoimeid: süstekoha valu, turse, punetus ja kuumus, jäsemevalu ja turse, lööve, sügelus, palavik, unisus, ärevus, rahutus, loidus, nutt. Üks isik sai samaaegselt puukentsefaliidi vaktsiini.
- Kahes teatises kirjeldati 8-aastastel lastel kõrvaltoimeid, mida tänastele teadmistele tuginedes ei ole neljavalentse vaktsiiniga seni seostatud: tugev alakõhuvalu (koos reide kiirguva valuga; laps paranes) ning tikid ja Gilles de la Tourette’i sündroom (esimesed nähud ilmnesid 2 aastat pärast vaktsineerimist).
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a neljavalentse vaktsiiniga 13 959 last.
Difteeria, teetanuse, läkaköha, poliomüeliidi, Haemophilus influenza B tüüp viievalentne vaktsiin (14 teatist)
- Kõigis teatistes kirjeldati teadaolevaid kõrvaltoimeid: süstekoha valu, turse, punetus ja kuumus, rahutus, kriiskav nutt, palavik, sügelus, nõgestõbi, palavikukrambid, isutus, oksendamine, unehäired.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a viievalentse vaktsiiniga 25 593 last.
Difteeria, teetanuse, läkaköha, poliomüeliidi, Haemophilus influenza B tüüp, hepatiit B kuuevalentne vaktsiin (4 teatist)
- Teatistes kirjeldati teadaolevaid kõrvaltoimeid: unehäired, rahutus, kõhulahtisus, ajutine hingeldus, vähenenud aktiivsus, nutt ja nutuhood, loidus, isutus, nahalööve.
- Kahes teatises kirjeldati imikutel kõrvaltoimeid, mida tänastele teadmistele tuginedes ei ole kuuevalentse vaktsiiniga seni seostatud: 6-kuusel lapsel nahakuivus ja lööve 1-2 nädalat pärast vaktsineerimist (nähud kordusid igal vaktsineerimisel), motoorika ja aktiivsuse langus; 3-kuusel lapsel suur süljevool ja aeglasemad liigutused.
Kolm last said samaaegselt rotaviiruse vaktsiini. Kõik lapsed paranesid täielikult.
Terviseamet on vaktsineerijatele ajavahemikus 1.01.2018 – 8.02.2019 väljastanud 34 000 annust kuuevalentse vaktsiini annust.
Gripivaktsiin (16 teatist)
- Kolmevalentse gripivaktsiini kasutamisel kirjeldati teadaolevat kõrvaltoimet: nõgestõbi, mis allus allergiavastasele ravile ning patsient paranes.
- Neljavalentse gripivaktsiini kasutamisel kirjeldati enamuses juhtudest teadaolevaid kõrvaltoimeid: süstekoha turse, sügelus, punetus, tihkenemine ja valu, lümfisõlmede põletik, lööve, nõgestõbi, pearinglus, peavalu, vererõhu tõus, iiveldus ja oksendamine, lihas- ja liigesvalud, palavik, nohu, häälekaotus.
- Neljavalentse gripivaktsiini kasutamisel kirjeldati kolmes teatises kõrvaltoimeid, mida tänastele teadmistele tuginedes ei ole gripivaktsiiniga seni seostatud: tasakaaluhäired, silmade kuivus, kaela kangus.
- aastal väljastati Eestis hulgimüügist 123 041 gripivaktsiini annust.
Puukentsefaliidi vaktsiin (3 teatist)
- Kahes teatises kirjeldati teadaolevaid kõrvaltoimeid: süstekoha valu, peavalu, pearinglus, uimasus, kaela kangus, lihasvalu, iiveldus, halb enesetunne, ja õhetus
- Ühes teatises kirjeldati kõrvaltoimeid, mida tänastele teadmistele tuginedes ei ole puukentsefaliidi vaktsiiniga seni seostatud: kuumahood, keeletundlikkuse häire.
- aastal väljastati Eestis hulgimüügist 90 677 puukentsefaliidi vaktsiini annust (sh 27 069 laste vaktsiini).
Inimese papilloomiviiruse vaktsiin (14 teatist)
- Enamuses teatistes kirjeldati teadaolevaid kõrvaltoimeid: süstekoha valu ja turse, lihasvalu, peavalu, alaselja valu, iiveldus, oksendamine, nõrkus, väsimus, jõuetus, unisus, värisemine, vererõhu tõus (psühhogeense reaktsiooni osana), pearinglus, minestamine, lümfisõlmede suurenemine ja valu.
- Kolmes teatises kirjeldati kõrvaltoimeid, mida tänastele teadmistele tuginedes ei ole inimese papilloomiviiruse vaktsiiniga seni seostatud: liigeste turse ja valu (põlved, randmed) ja tugevad lihasspasmid, valu silmades.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a papilloomiviiruse vaktsiini ühe annusega 4743, kahe annusega 9021 ja kolme annusega 105 tütarlast.
Leetrite, mumpsi ja punetiste (MMR) kolmevalentne vaktsiin (5 teatist)
- Neljas teatistes kirjeldati teadaolevaid kõrvaltoimeid: palavik, lööve.
- Ühes teatises kirjeldati 13-aastasel tüdrukul kõrvaltoimet, mida tänastele teadmistele tuginedes ei ole MMR vaktsiiniga seni seostatud: pindmise näonärvi põletik (ühepoolne näohalvatus ehk Belli paralüüs), mis avaldus vaktsineerimisele järgmisel päeval. Patsient paranes täielikult paari kuuga.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a MMR vaktsiiniga 13 351 inimest ja revaktsineeriti 11 867 inimest
Pneumokokkvaktsiin (1 teatis)
- 10 kuu vanusel lapsel tekkis palavik. See on teadaolev kõrvaltoime, laps paranes täielikult.
- aastal väljastati Eestis hulgimüügist 2028 pneumokokkvaktsiini annust (lisaks 192 annust pneumokokk- ja Haemophilus influenzae vaktsiini annust).
Kollapalaviku vaktsiin (1 teatis)
- 45-aastasel mehel tekkisid väsimus, liiges- ja lihasvalu, palavik, külmavärinad, nõrkus. Need on teadaolevad kõrvaltoimed.
- aastal väljastati Eestis hulgimüügist 1891 kollapalaviku vaktsiini annust.
Tuberkuloosi nõrgestatud elusvaktsiin (BCG) (1 teatis)
- 3 kuu vanusel lapsel tekkis lokaalne põletikuline infiltraat, haavandumine, põletikuline paapul. See on teadaolev kõrvaltoime. Laps oli teatamise hetkel paranemas.
Terviseametile esitatud aruannete kohaselt vaktsineeriti 2018. a tuberkuloosi vaktsiiniga 13 306 last.
2018 aastal väljastati Eestis hulgimüügist apteekidele ja haiglatele ligikaudu 458 768 vaktsiiniannust. Arvestades vaktsiinide kasutuse ulatust ja teatatud tõsiste kõrvaltoimete arvu, võib öelda, et vaktsiinid on väga ohutud ravimid. Nende kasutamisest saadav kasu (haiguse ärahoidmine) ületab kindlalt võimalikud ohud.
Vaktsineerimise järgselt võivad sageli tekkida paiksed nähud (turse, valu) ja kerge palavik, mis on normaalsed reaktsioonid ning mööduvad tavaliselt mõne päeva jooksul ilma spetsiifilise ravita. Vajadusel võib kasutada valu- ja palavikuvastaseid ravimeid (nt paratsetamool, ibuprofeen) ja paikseid vahendeid (nt külmakompress).
RASESTUMISVASTASTE RAVIMITE KÕRVALTOIMED
- aastal saadeti Ravimiametile 25 teatist kontratseptiivide võimalike kõrvaltoimete kohta (neist üks duplikaat – st nii arst kui müügiloa hoidja teavitasid samast kõrvaltoimest).
Levonorgestreeli sisaldavad emakasisesed vahendid (17 teatist)
Tõsised kõrvaltoimed (8 teatist):
- Kuuel korral teatati ravimi ebaefektiivsusest: neljal korral rasedusest (neist kahel juhul lõppes rasedus spontaanabordiga), kahel korral emakavälisest rasedusest (ühel juhul oli vajalik munajuha kirurgiline eemaldamine, teisel juhul toimus iseeneslik abort)
- Ühel juhul teatati tugevast emakaverejooksust
- Ühel juhul teatati vahendi nihkumisest ja emaka perforatsioonist ning armistumisest
Mittetõsised kõrvaltoimed (9 teatist)
- Teatistes kirjeldati teadaolevaid kõrvaltoimeid: juuste väljalangemine, ripsmete ja kulmukarvade väljalangemine, vahendi väljalangemine, valu/tugev valu alakõhus, vaginaalne veritsus, emaka hüpertroofia, amenorröa, munasarjatsüst, ebamugavustunne kõhus
- Kahes teatises kirjeldati lisaks kõrvaltoimeid, mida tänastele teadmistele tuginedes ei ole levonogestreeliga seni seostatud: veenipõletik (flebiit), silma liigutushäire, fokusseerimisraskus
Levonorgestreeli sisaldav esmaabipill (1 teatis, mittetõsine)
- 1 juhul teatati allergilise lööbe, sügeluse ja hingamisraskuste tekkest, mis möödusid raviga.
Desogestreeli sisaldavad suukaudsed kontratseptiivid (3 teatist, mittetõsised)
- Teatistes kirjeldati teadaolevaid kõrvaltoimeid: kõriturse, lööve, sügelus, valu säärtes (nn veenivalu), surisemistunne jalasäärtes, kõhuvalu, peavalu, väsimus, depressiivne meeleolu, ebakorrapärane veritsus.
- Ühes teatises kirjeldati lisaks kõrvaltoimet, mida tänastele teadmistele tuginedes ei ole desogestreeliga seni seostatud: uimasus.
Etonogestreeli sisaldav nahaalune implantaat (2 teatist)
- Teatistes kirjeldati teadaolevaid kõrvaltoimeid: implantaadi nihkumine, närvikompressioon ja sellest tingitud sõrmede tuimus.
Gestodeeni ja etünüülöstradiooli sisaldav suukaudne kontratseptiiv (1 teatis, tõsine)
- 24-aastasel naisel tekkis 10 kuud pärast kontratseptiivi kasutamise alustamist isheemiline insult, mis vajas ravi. Patsient paranes.
Kontratseptiivide valikul tuleb alati kaaluda kasu ja riski suhet – vt (link 2018 avaldatud kontratseptiivide infole) Kombineeritud hormonaalsed kontratseptiivid – trombemboolia risk
- aastal müüdi Eestis hulgimüügi statistika andmetel hormonaalseid emakasiseseid vahendeid 8249 (st uued kasutajad). Teisi kontratseptiive (vaginaalsed, suukaudsed, transdermaalsed, implantaadid) kasutas hinnanguliselt 37 657 naist.
KÕRVALTOIME TEATISED PATSIENTIDELT
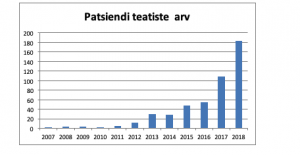
Patsiendi teatiste arv on aasta-aastalt suurenenud – 2018. a edastati 184 teatist.
- 93 teatist Ravimiametile (1 korral apteekri abiga)
- 91 teatist müügiloa hoidjale (kuuel korral apteekri abiga)
Patsiendid teatasid kõige rohkem vaktsiinide kasutamisel ilmnenud kõrvaltoimetest – 42 teatist (neist on pikemalt lõigus VAKTSIINIDE KÕRVALTOIMED). Järgnevad immuunsüsteemi mõjutavad ravimid (hulgiskleroosi ja psoriaasi raviks) – 32 teatist, antibakteriaalsed ravimid – 14 teatist, rasestumisvastased ravimid – 10, antidepressandid – 9, tromboosivastased ained – 7.
Teatatud kõrvaltoimed on enamuses teadaolevad (st ravimiteabes kirjas). 38 teatises kirjeldati 57 kõrvaltoimet, mida seni ei ole ravimi või vaktsiiniga seostatud.
18 teatises kirjeldati 38 tõsist kõrvaltoimet, neist 3 teatises kirjeldati 4 kõrvaltoimet, mida seni ei ole kirjeldatud vastava ravimi või vaktsiiniga:
- kaks teatist vaktsiinide kohta (neist on pikemalt lõigus VAKTSIINIDE KÕRVALTOIMED)
- üks teatis tamsulosiini ja alfusosiini kasutamisel tekkinud nägemishäire ja katarakti (kae) tekkest 77-aastasel patsiendil, kellel lisaks esines kaasuvate haigustena silmahaigus (maakula degeneratsioon), kõrgvererõhutõbi, jäsemearteri aneurüsm, kõigi haiguste raviks kasutas teisi ravimeid.
Patsiendi saadetud kõrvaltoime teatiste väärtus on suurem, kui Ravimiamet saab küsida raviarstilt lisaandmeid ja meditsiinilist kinnitust, mis aitavad hinnata võimaliku kõrvaltoime ja ravimi vahelist seost. Seetõttu oleks hea, kui patsiendid annaksid Ravimiametile arsti kontaktid. Paraku on 184 teatisest meditsiiniline kinnitus vaid 42 teatisel (26%).
Meditsiinilise kinnituse puudumise põhjused on erinevad:
- patsient keeldus arsti kontakte andmast;
- patsient lubas arstiga ühendust võtta, kuid ei edastanud arsti nime;
- teatises kirjeldati teadaolevaid, sageli või väga sageli esinevaid kõrvaltoimeid, mis ei vajanud meditsiinilist kinnitust;
- patsiendi edastatud jätkuinfost selgus, et kaebuste näol oli tegemist muu haigestumisega, millel puudus seos ravimi/vaktsiiniga.
Häirivast kõrvaltoimest peab arstile rääkima, sest kõrvaltoime võib vajada ravi, ravimi annus vähendamist või ravim teisega asendamist. Tekkinud reaktsioon võib olla uus haigusseisund, mis võib omakorda vajada (teistsugust) ravi või ka täiesti omaette esinev kaasuv haigus. Patsiendil on seda raske endal hinnata. Omaalgatuslikku ravi katkestamist või annuse vähendamist tuleb vältida, sest nii võib põhihaigus süvendada, kui just ei ole tegemist ravimi kõrvaltoimega, mille puhul on pakendi infolehes soovitatud, et ravi tuleks katkestada ja kohe arstiga ühendust võtta.
Sõltumata meditsiinilise kinnituse saamisest edastatakse kõik kõrvaltoime teatised Euroopa kõrvaltoimete andmebaasi, mille puhul teatise saatjal on tekkinud kahtlus kõrvaltoime seosele ravimi või vaktsiiniga. Lisaks meie hindamisele hinnatakse teatisi Euroopas ühtselt juhtiva liikmesriigi eestvedamisel suure andmebaasi põhjal, võttes arvesse ka võimalikke statistilisi ohusignaale.
Euroopa andmebaasi teatatud kõrvaltoimeid saab igaüks ise vaadata: http://www.adrreports.eu/
Samas tuleb meeles pidada, et Euroopa andmebaas sisaldab kõiki teatatud võimalikke kõrvaltoimeid – nii neid, millel on (võimalik) seos ravimiga kui neid, millel seos puudub.
KÕRVALTOIMETE OODATAV TEATAMISE SAGEDUS
Rahvusvahelise kogemuse põhjal tuleks seniteadmata kõrvaltoimete õigeaegseks avastamiseks saada iga-aastaselt 1 miljoni elaniku kohta vähemalt 200 kõrvaltoime teatist, neist 30% või enam peaksid olema võimaliku tõsise kõrvaltoime kohta ning enam kui 10% arstidest peaks teatama vähemalt ühest kõrvaltoimest. 2018. aastal oli Eesti kõrvaltoime teatiste arv 379 teatist/miljoni elaniku kohta ning tõsiste kõrvaltoimete osakaal 34,8%.
Hindame kõrgelt kõigi panust, kes on meile edastanud olulist infot võimalike kõrvaltoimete kohta.
KUIDAS TEATADA KÕRVALTOIMEST
Kõige lihtsam on kõrvaltoimest teatada Ravimiameti veebilehe kaudu täites elektroonilise teatise meie veebilehel, kus on eraldi vormid ja juhendid patsiendile ja arstile.
Kõrvaltoimest võib Ravimiametit teavitada ka e-kirja (pharmacovig@ravimiamet.ee), posti (Nooruse 1, 50411 Tartu) või telefoni (7374 140) teel.
Täiendav teave:
e-post: pharmacovig@ravimiamet.ee
telefon: 7 374 140
